КРИСТАЛЛИЧЕСКИЕ ЦЕМЕНТ-ЛЮМИНОФОРЫ. ОКИСИ. КАРБОНАТЫ. АЦЕТАТЫ.
ОКИСИ
В 1937 году Травничеком (M. Travnicek) была опубликована работа по открытию новой группы люминофоров, занимающее место между настоящими органолюминофорами типа борной кислоты и органическими кристаллолюминофорами. Основой в этой группе люминофоров являются основные соли окислов Mg, Ca, Zn, галогениды бериллия, а так же сульфаты, нитраты, фосфаты, формиаты и др. Эти основные соли получаются смешиванием тонко измельчённых порошков вышеуказанных окислов металлов с концентрированными растворами соответствующих солей. При этом образуются цементоподобные массы –например, цемент Сореля из смеси MgO + MgCl2 и др. Для ускорения процесса схватывания массы, смесь подвергается нагреванию.
Количества воды или спирта, вводимых для схватывания, влияют на качество люминофоров, активируемых такими же органическими веществами, как и витроидальные органолюминофоры. Для лучших результатов, количество воды должно быть таково, что бы смесь приняла тестообразную консистенцию и могло быть хорошо размешано. Затвердевание смеси происходит при медленном нагреве на водяной бане. Наилучшее свечение дает MgOCl.
Активация флуоресцеином (Уранин А). Люминофоры хорошо возбуждаются дневным светом и имеют область поглощения d1 = 466 нм. MgOCl-флуоресцеин получается смешиванием в агатовой ступке 1,0 г MgO + 0,5 мл MgCl2. (MgCl2 = 0,129 г) + 0,04 мг уранина в 0,2 мл воды. Смесь медленно нагревают до 160°С. Люминофор излучает две полосы: широкую жёлто-зелёную с пиком λmax = 527 нм, имеющую при t = 22°C длительность в 20 секунд; и вторую – оранжевую, с максимумом λmax = 610-620 нм. От ультрафиолетового излучения появляется третья полоса β — λ = 496-470 нм. Избыток MgOCl ухудшает люминесценцию. Аналогично MgO действуют окиси бериллия, кальция, стронция, бария и La2O3.
Активация терефталевой кислотой. Люминофор MgOCl-терефталевая кислота хорошо возбуждается ртутной лампой и имеет излучение λ = 400- 650 нм, приближённая λmax = 490-500 нм. Длительность 40 секунд.
Активация карбазолом. Карбазол дает ряд очень ярких люминофоров, обычно имеющий две полосы: первую, которая α — λ = 420-700 нм, с максимумом λmax = 490 нм, и вторую β — λ = 428-440 нм. Они излучают голубой свет. MgOCl-карбазол получается смешением 1.0 г MgO + (0,129 г MgCl2 + 0,5 мл H2O) + (0,13 мг карбазола + 0,25 мл 96%-ного этанола). Нагрев 30 минут до 150°С. Затухание фосфоресценции у этого люминофора длится 2 часа, (!) при 100°С только 20 минут. MgOBr-карбазол получается смешиванием 1.0 г MgO + (0,25 г MgBr2 + 0,5 мл H2O) + (0,135мг карбазола + 0,25 мл 96%-ного этанола). Нагревают до 157°С. Длительность свечения 20 секунд. MgO·KJ-карбазол плохой люминофор с длительностью в 20 секунд. ZnOCl-карбазол то же плох. Длительность 6 секунд. CaO·LiCl-карбазол даёт светло-голубое свечение, хорош для дневного света, длительность 18 секунд.
Активация фенантреном. Фенантрен даёт яблочно-зелёное свечение. MgOCl-фенантрен получается смешиванием 1.0 г MgO + (0,179 г MgCl2 + 0,5 мл H2O) + (0,2 мг фенантрена + 0,5 мл H2O). Нагревают до 152°С. Хорошо возбуждается от видимого света. Ещё лучше от ультрафиолета. Длительность 40 секунд. Имеет две полосы – первую β с λ = 468-477 нм, и вторую α с λ = 506 и 517 нм. Светится ярко при нагревании. MgOBr-фенантрен имеет длительность 15 секунд и полосы λ = 700-420 нм.
Активация нафталином. Дает люминофоры только с MgOCl и MgOBr с жёлтым свечением и полосами: γ — λ = 600-650 нм, альфа бета = 556, 525, 477 нм. MgOBr-нафталин, только β с λ = 477 нм, и длительность до 10 секунд. MgOCl-нафталина длительность 16 секунд.
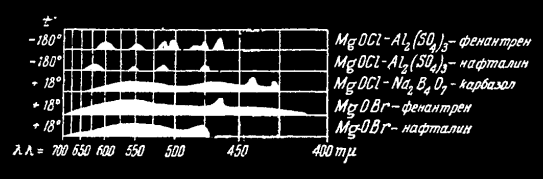
Спектры свечения органолюминофоров.
Кроме того, яркие люминофоры дают с MgOCl фенилцинхониндиметиловый эфир, светящийся от ртутной лампы ярким золотисто жёлтым цветом, и диметиламинофенилдиметилпиразолон – беловато-голубой. Так же хорошие результаты получаются с антраценом, гидрохиноном и красной магдалой.
Люминофоры обладают гасящим фотоэффектом – окрашиваются в голубой цвет, пропадающий в темноте. Это явление называется фототропия. Полосы от ртутной лампы узкие, от дневного света широкие.
КАРБОНАТЫ
В 1938 году Хомзе (H. Chomse) и Лютценбергер (Lützenberger) нашли ещё одну группу органолюминофорв на базе неорганических соединений. В качестве последних были испытаны карбонаты кальция, стронция и бария. Наилучшие результаты были пролучены с CaCO3, SrCO3 дал почти тождественные люминофоры по качеству, но с BaCO3 были получены люминофоры лишь со слабой фосфоресценцией.
Получение люминофоров происходило следующим образом. 3 г Ca(NO3)2 очищенного от органических примесей (что может быть достигнуто кристаллизацией из азотной кислоты в присутствии перекиси водорода или прокаливанием нитрата кальция до расплавления, но не выше температуры разложения, с дальнейшей фильтрацией растворенного в воде расплава от углеродистых остатков и перекристаллизацией из кислого раствора с добавлением перекиси водорода) растворялись в 15 мл воды и карбонат кальция осаждался 20%-ным раствором карбоната аммония, после чего промывался небольшим количеством воды. Перед осаждением в один из растворов вводился органический активатор. Наилучшие результаты получались с гликолем, лейцином, тирозином, мочевой и гиппуровой кислотами в количестве 0,5-0,1% насыщенного раствора. Значительно хуже aльфа-аланин, не действенны сахароза, салициловая и α-оксинафтойная кислоты, флуоресцеин.
Исключительно сильно активирует терефталевая кислота при 0,5-0,01% (растворена в карбонате аммония). В этом случае наблюдается очень яркое, чисто голубое свечение. Для получения люминофора необходимо прокаливание при 370-430°С. При более низких температурах в (200-300°) фосфоресценция незначительна, а при более высоких (620-750°) исчезает. Наряду с фосфоресценцией имеется и флуоресценция, увеличивающаяся с температурой прокаливания, переходя с белого через голубоватое в жёлтоватое свечение. Цвет фосфоресценции при этом меняется от сине-зелёного до зелёного( при оптимуме прокаливания), а далее опять делается сине-зелёным. Длительность её порядка 20 секунд. Длительность прокаливания особого значения не оказывает в интервале от получаса до полутора часов.
Люминофоры не дают гасящего трибоэффекта и термолюминесценции и не возбуждаются от катодных лучей. С повышением температуры свечение ухудшается. Наилучшее возбуждение – от ультрафиолета высокой интенсивности.
АЦЕТАТЫ
Весьма любопытный класс органолюминофоров на основе ацетатов Pb, Ba, Cd, был открыт в конце 30-х годов Рэндаллом (I.T. Randall). Оригинальной особенностью этих люминофоров является избирательность активации кристалла по граням. Эти ацетаты кристаллизуются в моноклинной системе и ограничены плоскостями четырёхгранной тупой пирамиды. Данные плоскости, представляющие собой треугольники, расположены симметрично попарно. Входящий в кристалл активатор (краситель) избирательно локализуется на какой либо из пар плоскостей – либо расположенной по отношению к широкой стороне кристалла (длинносторонняя ориентация), либо по отношению к короткой (короткосторонняя ориентация). По этому способностью к люминесценции обладает лишь та сторона кристалла, на которой активатор локализовался. Отсюда при возбуждении люминесценции кристалл светит избирательно, давая либо длинностороннюю либо короткостороннюю люминесценцию (langseitige und breitseitige lumineszenz). Так как одни активаторы вызывают длинностороннюю, а другие короткостороннюю люминесценцию, то, активируя кристалл двумя такими активаторами, получаем на разных симметрично расположенных плоскостях разную люминесценцию. Причина этого избирательного активирования на тот момент не выяснена.

Схема ориентации люминесценции ацетатов по плоскостям кристаллов.
Для получения этих люминофоров добавляют в горячий концентрированный раствор ацетата свинца краситель в отношении 1:1000. Раствор фильтруют горячим и медленно кристаллизуют. Флуоресцеин дает длинностороннюю яркую жёлтую люминесценцию с интенсивностью 8 (по Ленарду). Родамин 6G даёт короткостороннюю жёлто-красную и длинностороннюю жёлтую люминесценцию. По этому часть кристалла светится жёлтым, а другая часть оранжевым цветом с резкими ограничительными линиями по граням. Аналогично ведёт себя родамин В-500, но с той разницей, что он даёт лишь красную короткостороннюю люминесценцию. Если же смешать флуоресцеин с родамином В-500, то возникает жёлтая длинносторонняя от флуоресцеина и короткосторонняя красная от родамина В-500, которые резко отличаются друг от друга.

На снимке кристаллы ацетата бария
Аналогично ацетату свинца ведёт себя ацетат кадмия. Вообще, длинностороннюю люминесценцию дают флуоресцеин, эозин, нафталевый ангидрид. Короткостороннюю – родамин (сильную), аурамин (слабую желтую). Триклинный ацетат бария дает с флуоресцеином и всеми родаминами короткостороннюю люминесценцию.
Окрашенные кристаллы сильно разрушаются на воздухе и на свету, в то время как чистые реактивы ацетатов устойчивы.
При тестировании образцов люминофоров с использованием ультрафиолетовых светильников диапазона (В) и особенно (С) следует применять соответствующую защиту для глаз. Запрещается подвергать открытые участки тела жёсткому ультрафиолету ртутного светильника сверх установленных норм.
Литература:
·Вавилов С.И. Люминесценция; 1938.
·Левшин В.Л. Свечение активированных кристаллов; 1951.
·Жиров Н.Ф.. Люминофоры; 1940.
·Использованы периодические издания ХХ-го века, представляющие только исторический интерес.
Материал составлен для сайта chemlight.ucoz.ru
При перепечатке этой статьи ссылка на сайт обязательна.
Argentus/Donetsk/2013 |  .
. КРИСТАЛЛИЧЕСКИЕ ЦЕМЕНТ-ЛЮМИНОФОРЫ. ОКИСИ. КАРБОНАТЫ. АЦЕТАТЫ.
КРИСТАЛЛИЧЕСКИЕ ЦЕМЕНТ-ЛЮМИНОФОРЫ. ОКИСИ. КАРБОНАТЫ. АЦЕТАТЫ.
 .
. КРИСТАЛЛИЧЕСКИЕ ЦЕМЕНТ-ЛЮМИНОФОРЫ. ОКИСИ. КАРБОНАТЫ. АЦЕТАТЫ.
КРИСТАЛЛИЧЕСКИЕ ЦЕМЕНТ-ЛЮМИНОФОРЫ. ОКИСИ. КАРБОНАТЫ. АЦЕТАТЫ.