ВИТРОИДАЛЬНЫЕ ОРГАНОЛЮМИНОФОРЫ.
ОРГАНОСУЛЬФАТЫ
Группа витроидальных люминофоров была исследована Травничеком (M. Travnicek) ещё в середине 30-х годов прошлого столетия и была расширена исследованиями Тиде (E. Tiede) и Хомзом (H. Chomse). Первым были получены стекловидные сплавы многих полуобезвоженных сульфатов, активированных органическими активаторами подобно борной кислоте. Фосфоресценция получалась с сульфатами Be, Zr, Th, Al. Сплавление производилось при 130-140°С до частичного обезвоживания и застывания в стекло или твёрдую пену. В качестве активаторов при органосульфатных люминофорах, Травничеком были применены флуоресцеин, терефталевая кислота, фталевый ангидрид, родамин, эскулин, фенантрен.

Оптимум активации наступает для флуоресцеина при отношении 0,003:1 Al2(SO4)3 (безводный), но свечение имеет место ещё и при отношении 10-6:1 Al2(SO4)3. Свечение состоит из пяти полос и сильно зависит от концентрации активатора и температуры.
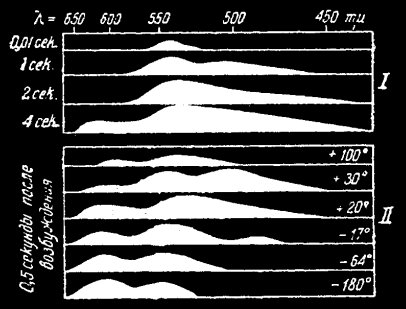
На первом графике спектры органосульфатов по Травничеку. I – изменение спектра при затуханиях; II – изменения спектра излучения от температуры.
Органосульфатные люминофоры с флуоресцеином своеобразны по своему отношению к растиранию: при этом наблюдается не только падение интенсивности, но и появление более голубоватого тона свечения, особенно при увеличении концентрации флуоресцеина. Эффект не тождественен с обычным гасящим трибоэффектом, так как уничтожается, например, при смачивании ацетоном. Кроме того, Травничек исследовал влияние различных вторичных основ. Например, возможно введение ацетата алюминия с оптимумом, отвечающий формуле 3Al2(SO4)3·Al2O3 (последний из расчёта на ацетат).
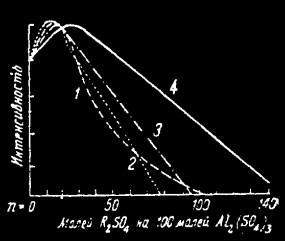
На графике 2: влияние вторичных основ на свечение флуоресцеина в сульфате алюминия по Травничеку: 1 - Li2SO4, 2 - K2SO4, 3 - Na2SO4, 4 - (NH4)2SO4
Из прочих вторичных основ были испытаны сульфаты K, Na, Li, NH4, которые несколько повышали интенсивность без изменения цвета. Сульфаты Mg, Zn, Cd, Sn инертны, H2SO4, H2SeO4, H2TeO4, сульфаты таллия и ртути действуют угнетающе, особенно последний, который, кроме этого делает свечение более желтоватым. ZnCl2 увеличивает интенсивность и снижает длительность, делая свечение желтоватым, особенно при терефталевой кислоте. Хлориды, а особенно бромиды вообще снижают интенсивность. Сульфаты Be, Zr, Th изменяют цвет свечения и могут служить самостоятельной основой для витроидальных люминофоров. Так, BeSO4 активированный флуоресцеином, при –180°С, дает оранжево-красное свечение, алюминий – желтое. Селенаты светят хуже, теллураты не светят совершенно.
Для получения сульфатных люминофоров по Травничеку, необходимо наличие некоторого количества воды в люминофоре. Безводные сульфаты не светят при активации органическими активаторами. Борные и сульфатные люминофоры 3Al2(SO4)3·18H2O изучались так же В.Л. Левшиным и Л.А. Винокуровым. Обезвоживание производилось при 135°С, с активацией флуоресцеином, эозином, эритрозином, эскулином и нафталевой кислотой. Левшин и Винокуров пришли к следующим итогам:
• закон затухания строго экспоненциальный.
• при большем увеличении концентрации активатора наступает уменьшение интенсивности и длительности свечения, сопровождающееся сдвигом свечения в сторону длинных волн, что раньше было найдено Н.Ф. Жировым для системы H3BO3 – флуоресцеин.
• параллельно фосфоресценции наблюдается и флуоресценция.
• витроидальные органосульфатные люминофоры по своим характеристикам особенно близки к витроидальным сахарозным люминофорам.
ОРГАНОФОСФАТЫ
Фосфоресценция гидроксилапатита Ca10(PO4)6(OH)2 была изучена Тиде и Хомзом. Эти исследования были вызваны наблюдениями над известным фактом люминесценции зубов в ультрафиолетовом свете. Зубы дают свечение голубовато-белого цвета, не очень интенсивное, продолжающееся несколько секунд в зависимости от интенсивности возбуждающего излучения.
Гидроксилапатит изготовлялся по методу Шлееде растворением Ca3(PO4)2 в слабой HCl с последующим осаждением избытком NH4OH. Осадок подвергался 36-часовому гидролизу на водяной бане и затем активировался, после чего прокаливался не выше 430°С. Активация производилась различными белковыми веществами, причём наилучшие результаты дали гликоколь, тирозин, гиппуровая кислота, лейцин, желатин, коллаген в 0,1%-ных растворах KOH. Возбуждающее излучение имеет максимумы d1 = 270 нм, d2 = 250 нм, d3 = 230 нм. Спектр излучения λ = 700-400 нм, с пиком λmax = 560-460 нм.
Дальнейшие исследования проводились над кальциевым фосфатом Ca(H2PO4)2·H2O, который будучи активирован, при отщеплении воды даёт белую, тяжёлую, пузырчатую массу, необычайно ярко светящуюся при охлаждении. При нагревании гидрата до 100°С уже теряется вода, но максимальная люминесценция наблюдается при 250°С. Дальнейшее обезвоживание ухудшает качество люминофора. При нагреве очевидно получается смесь мета- и пирофосфата mCa(PO4)2·nP2O5, т.е. система почти аналогичная борным люминофорам. Поскольку температура получения почти на 100° выше, чем для борных люминофоров, не все активаторы могут оказывать соответствующее действие. Наиболее интенсивные препараты получаются с флуоресцеином и терефталевой кислотой в концентрациях 1:500–1:10000 по отношению к фосфату. Люминофор с терефталевой кислотой светит только от коротковолнового излучения ярким голубым цветом. Свечение спадает через несколько секунд и продолжается около одной минуты. Флуоресцеин хорошо возбуждается и от видимого спектра и светит очень ярким зелёно-синим цветом. При охлаждении жидким воздухом, свечение становится чисто жёлтым. A-оксинафтойная кислота даёт плохой эффект. Салициловая кислота, антрацен и фенантренхинон не действуют вовсе. Бензолтрикарбоновая и бензолтетракарбоновые кислоты дают хорошие результаты.
Люминофоры не обладают гасящим трибоэффектом и не возбуждаются от катодного, рентгеновского и радиоактивного излучений. На воздухе медленно поглощают влагу.
Хомзе продолжил исследования над органофосфатными люминофорами на основе солей Be(H2PO4)2, Mg(H2PO4)2, Sr(H2PO4)2, Ba(H2PO4)2, мета и пирофосфатных кислот. Be(H2PO4)2 был получен из Be(OH)2 + H3PO4. Вещество плохо кристаллизуется и гигроскопично, по этому его необходимо сохранять над H2SO4. Mg(H2PO4)2·2H2O получается аналогичным путём. Sr(H2PO4)2·H2O получают вливанием фосфорнокислого раствора SrCl2 в спирт. Ba(H2PO4)2 получают из BaCl2 осаждением Na2HPO4 и растворением осадка в H3PO4, с последующей кристаллизацией.
Активаторы вводились в концентрациях 1:3000, 1:1000, 1:500, 1:100. Люминофоры готовились обезвоживанием при 240°С на воздушной бане, в стекле или фарфоре. Люминофоры хорошо возбуждаются УФ, не имеют гасящего трибоэффекта, не светят от катодных и рентгеновских лучей. При слабом нагревании способность к фосфоресценции теряется. Наиболее яркое свечение у следующих препаратов:

Стронций и барий дают меньшую интенсивность, антрацен и акридин не светят. Плохо светят α-оксинафтойная, салициловая кислоты и фенантрен. Зато при смешивании уранина с терефталевой кислотой получается очень яркое и довольно длительное свечение. Наиболее яркое свечение отвечает формуле кислых пирофосфатов MeH2P2O7, почему люминофоры могут быть получаемы из RO + H2P2O7. Пирофосфаты Na и K тоже дают слабые органолюминофоры. Метафосфорная кислота даёт яркое свечение с уранином и терефталевой кислотой. Пирокислота – только при температуре жидкого воздуха. Рентгенограммы подтвердили стекловидное состояние этих люминофоров.
В 1938 году Глассер и Фонда опубликовали небольшую заметку об органолюминофорах апатитового типа, у которых, они предполагали наличие в апатитовой группировке органического остатка. В качестве последнего, исследователями вводились кальциевые соли молочной, янтарной и особенно винной кислот. Оптимум флуоресценции получался при совместном осаждении кальциевых солей смесью фосфата и тартрата натрия, с содержанием последнего в растворе около 11 моль%. Флуоресценция возбуждается от УФ, и вообще наблюдается при введении около 1% органических реагентов. А вот для самого получения органофосфатных люминофоров у авторов статьи указано, что необходим нагрев при 400°С. При более высокой температуре (600°) или выше естественно флуоресценция исчезает вследствие разрушения органических веществ. Авторы утверждали с оговоркой, что температура в 400°С эффективна лишь при прокаливании в присутствии кислорода воздуха. Но согласно запатентованным данным за 1938 год № 652609 полученным в Германии, рекомендуется частично гидратированный Ca(H2PO4)2·H2O прокаливать при 250°С, с органическими веществами – терефталевой, фталевой, бензолтетракарбоновой кислотами и флуоресцеином, о чем указано в этой статье выше.
САХАР И ЖЕЛАТИНА
Витроидальные органолюминофоры можно синтезировать и из чисто органических реактивов. На сегодняшнее время известно большое количество люминофоров, особенно с флуоресцеином, как активатором, получающихся из различных сплавленных, застывших или в состоянии коллоида веществ. На сегодня известны и описаны основания для этих люминофоров. Ими служат:
•Для органолюминофоров замерзания – спирты.
•Для органолюминофоров обезвоживания и плавления: кислоты винная, лимонная и проч. Углеводороды – сахар и др.
•Для люминофоров гидратации – разного рода белки, желатина и др.
В 1935 году Батша (A. Batscha) описал сплавление винной кислоты с флуоресцеином, в соотношении 1:5000 при 170°С, или же лимонную с флуоресцеином при 155°С, при этом получаются люминофоры светящиеся жёлто-зелёным цветом. С винной кислотой свечение происходит от +10 до –12°С. С лимонной кислотой свечение есть только при –12°С.
Особенно замечателен сахарный люминофор. Как вы успели догадаться, он может быть приготовлен на основе обычного сахара с различными органическими добавками. По наблюдениям С. Голуба, сахар с родулином ярко светит при обычной, комнатной температуре.
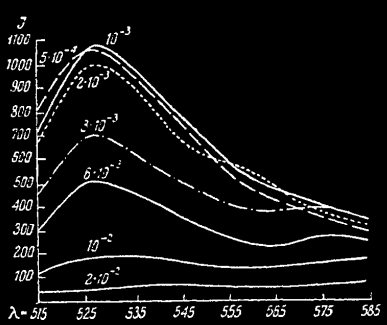
Спектры сахар—родулин-оранж, в зависимости от концентрации активатора по Левшину.
Эскулин дает ярко-голубую флюоресценцию и зелёную фосфоресценцию, которая продолжается в течение нескольких минут!
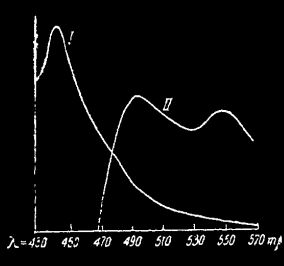
Спектры флуоресценции и фосфоресценции эскулина в сахаре по Вавилову и Левшину: I – флуоресценция; II – фосфоресценция.
Сахарные или сахар-люминофоры были обнаружены С.И. Вавиловым при участии В.Л. Левшина и описаны в 1926 году. Сахар-люминофоры активируются многими органическими веществами, в отличие от борных люминофоров – особенно красителями, среди которых применяется флуоресцеин. Активация в среднем 1:20000.
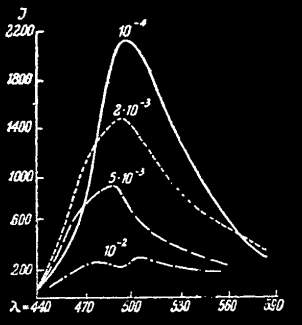
Спектры сахар-флуоресцеин люминофора в зависимости от концентрации по Левшину.
Сахар-люминофоры изготовляются следующим образом. Сахароза растворяется в равном или несколько меньшем количестве воды и активируется красителем порядка 0,0002:1-2 сахара. Постепенно упаривают воду, доводя осторожно температуру до 145°С, причём получается сахарный леденец. Для охлаждения леденца, расплав выливают на металлическую гладкую поверхность (желательно лист из нержавейки) для быстрого охлаждения. Более высокие температуры нагрева вызывают осмоление сахара, а при более низких значениях, полученные люминофоры слабо светят.
Быстрое охлаждение леденца, т.е. сахар-люминофора, необходимо. Эти люминофоры существуют несколько дней, после чего наступает процесс кристаллизации, сопровождающийся уничтожением свечения. Этот момент можно несколько оттянуть, добавляя к раствору при изготовлении совсем немного уксусной кислоты. Пыль, прикосновения острыми предметами, а так же сколы после охлаждения образца ускоряют процесс кристаллизации сахарного люминофора. Активаторами, помимо флуоресцирующих красителей могут служить иные, например, аурамин. Очень яркую флюоресценцию даёт родулин-оранж и яркое послесвечение порядка от нескольких секунд до полминуты. Эти люминофоры в световом излучении имеют три процесса – один мгновенный и два длительных, один из последних малой длительности порядка 1 сек. Сахар-люминофоры являются наиболее яркими представителями этого класса люминофоров, как в переносном, так и в прямом смысле слова.
Желатин-люминофоры подробно описаны у Шнобеля (W. Schnabel) в 1934 году, несмотря на то, что их обнаружили ещё в конце XIX-го века. Получаются прибавлением к 5%-ному раствору желатины несколько капель водного раствора красителя. Жидкость фильтруется желательно через совсем не плотный ватный фильтр и выливается на чистую стеклянную пластину, предварительно покрытую тонким слоем коллодия, после чего сушится и снимается со стекла. У желатин-люминофоров свечение обычно незначительно, порядка одна сотой секунды. Лишь акридинхлоргидрат и хининсульфат дают свечение порядка нескольких секунд. Активаторами могут служить многие красители: метилфиолет даёт ярко-красное свечение, фуксин в желатине даёт красный цвет, ауранция – жёлтый, аурамин – зелёный цвет.
При тестировании образцов люминофоров с использованием ультрафиолетовых светильников диапазона (В) и особенно (С) следует применять соответствующую защиту для глаз. Запрещается подвергать открытые участки тела жёсткому ультрафиолету ртутного светильника сверх установленных норм.
Литература:
·Вавилов С.И. Люминесценция; 1938.
·Левшин В.Л. Свечение активированных кристаллов; 1951.
·Жиров Н.Ф.. Люминофоры; 1940.
·Использованы периодические издания ХХ-го века, представляющие только исторический интерес.
Материал составлен для сайта chemlight.ucoz.ru
При перепечатке этой статьи ссылка на сайт обязательна.
Argentus/Donetsk/2013 |  .
. ВИТРОИДАЛЬНЫЕ ЛЮМИНОФОРЫ. ОРГАНОСУЛЬФАТЫ. ОРГАНОФОСФАТЫ. САХАР. ЖЕЛАТИНА
ВИТРОИДАЛЬНЫЕ ЛЮМИНОФОРЫ. ОРГАНОСУЛЬФАТЫ. ОРГАНОФОСФАТЫ. САХАР. ЖЕЛАТИНА
 .
. ВИТРОИДАЛЬНЫЕ ЛЮМИНОФОРЫ. ОРГАНОСУЛЬФАТЫ. ОРГАНОФОСФАТЫ. САХАР. ЖЕЛАТИНА
ВИТРОИДАЛЬНЫЕ ЛЮМИНОФОРЫ. ОРГАНОСУЛЬФАТЫ. ОРГАНОФОСФАТЫ. САХАР. ЖЕЛАТИНА