Люминофоры с достаточно длительным послесвечением на основе сульфида магния MgS не возможно приготовить из карбоната металла, как в случаях с карбонатами кальция, стронция и бария.
В силу своих химических свойств и способности взаимодействия, из карбоната магния при реакции с серой и восстановителями может получится только окись. По этому, магниевые светосоставы готовят только уже из готовой основы – сульфида магния достаточной чистоты. Другие способы получения этого соединения требуют высокой температуры.
Свойства сульфида магния
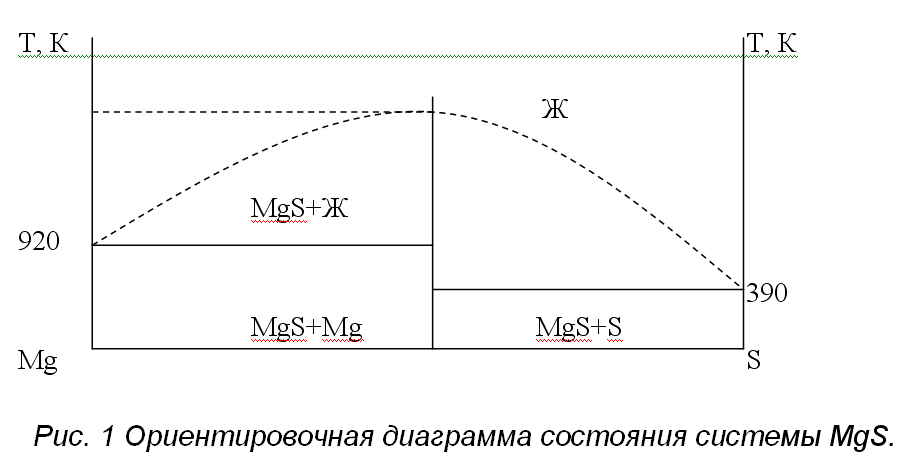
Моносульфид MgS имеет кубическую кристаллическую структуру типа NaCl. Структура MgS образуется сочетанием довольно объемных анионов серы и значительно меньших по размерам катионов металлов. Можно предполагать, что анионы серы как более крупные по размерам имеют тенденцию к регулярному расположению в элементарных ячейках довольно тесно один возле другого; они образуют при этом пустоты, в которых располагаются катионы. Каждый ион магния окружен шестью ионами серы, расположенными в вершинах правильных октаэдров. В системе Mg-S (рис.1) образуется единственная фаза MgS. Температура плавления составляет 2270К, при которой MgS разлагается.
 MgS представляет собой бесцветные (или розовато-красные из-за примесей) кубические кристаллы с решеткой типа NaCl (межатомные расстояния 2,89 А) и плотностью 2,79 гр/см3. Они плавятся при температуре 2000°С, фосфоресцируют, вызывают красное катодное свечение, трудно растворимы в воде, реагируют с холодной водой: MgS представляет собой бесцветные (или розовато-красные из-за примесей) кубические кристаллы с решеткой типа NaCl (межатомные расстояния 2,89 А) и плотностью 2,79 гр/см3. Они плавятся при температуре 2000°С, фосфоресцируют, вызывают красное катодное свечение, трудно растворимы в воде, реагируют с холодной водой:
3MgS + 2HOH = Mg(HS)2 + 2MgO + H2S
При гидролизе MgS в теплой воде образуется окись магния и сероводород:
MgS + HOH = MgO + H2S
Разбавленные кислоты, такие как HF, HCl, H2SO4, реагируют с MgS, образуя соли и H2S.
Cl, Br, I энергично реагируют с нагретым выше 300°С MgS, образуя соответствующие галогениды. Двуокись углерода под давлением 50-100 мм.рт.ст. реагирует с MgS, нагретым выше 660°С:
MgS + CO2 = MgO + COS
Получение MgS
Способы получения сульфида магния:
1. Mg+S = MgS (реакция происходит в фарфоровой трубке при 800°С)
2. 2Mg + S + H2S = 2MgS + H2 (температура 600-650°С)
3. MgO + CS2 = 2MgS + CO2 (температура 700-900°С)
Самым наверное простым и лучшим способом синтеза сульфида магния является взаимодействие порошкообразного магния с сероводородом при несильном нагреве до 600°С, и при слабом токе газа примерно 8 мл/мин.
Весь синтез очень удобно проводить в стеклянной, слегка изогнутой трубе из стекла пирекс или другого закаленного стекла. Работу проводят в лаборатории, оснащенной вытяжным шкафом.

В пирексовую трубку, снабжённую двумя пробками с газоотводами, загружают самый чистый магниевый порошок толщиной слоя в 1-1,3 см. От чистоты магния зависит качество конечного продукта и дальнейшее качество самого люминофорного состава. Так что рекомендуется применять магниевый порошок наивысшей чистоты.
Один вывод подсоединяют к источнику сероводорода (ППГ) или баллон. Другой вывод газоотвода трубки к поглотительной склянке со щелочью через предохранительную склянку, что бы при разности давления щелочь не попала в трубку с приготовленным сульфидом. После того как сероводород вытеснит воздух из реакционной трубки начинают интенсивный нагрев порошка магния до 600°С. В дальнейшем по ходу прохождения реакции на половину нагрев уменьшают до 450°С и уменьшают ток газа до минимальной величины. После полного прохождения реакции, нагрев прекращают и остужают трубку продолжая очень слабо пропускать сероводород.
Затем полученный сульфид магния выгружают и пакуют в герметичную тару.
Полученный продукт обладает теми же примесями, что и исходный магний с содержанием основного вещества минимум 99,5%.
Полученный сульфид магния белый порошок, синтезированный из высокочистого магниевого порошка пригоден для синтеза люминофоров во всех отношениях. Стоит упомянуть, что для приготовления составов из чистых синтезированных сульфидов, следует применять растворы солей активаторов на органических безводных растворителях: ацетоне, метаноле (под тягой!), этиловом эфире или этиловом спирте, соответственно подбирая соединения активирующего реактива, что бы оно было растворимо в определённом растворителе и в заданной концентрации.
Синтез магний-сульфидных люминофоров подробно освещён в этой статье.
Статья предоставлена форумом люминофоров http://chemlight.ucoz.ru/forum/
При копировании этой статьи ссылка на сайт обязательна
C Ув. Argentus/Donetsk
|  .
. СИНТЕЗ СУЛЬФИДА МАГНИЯ
СИНТЕЗ СУЛЬФИДА МАГНИЯ
 .
. СИНТЕЗ СУЛЬФИДА МАГНИЯ
СИНТЕЗ СУЛЬФИДА МАГНИЯ